Holoclar® è un prodotto di ingegneria dei tessuti per terapie avanzate consistente in un epitelio corneale umano autologo ricostruito ex-vivo contenente cellule staminali, indicato per la ricostruzione della superficie corneale in pazienti con mancanza di cellule staminali limbari dovuta ad ustioni oculari. È preparato partendo da un piccolo campione di cellule, ottenute attraverso il prelievo di una biopsia di 1-2 mm quadrati di limbus (la zona della cornea dove sono contenute le staminali corneali) non danneggiato da uno degli occhi, estratte e coltivate in laboratorio. Holoclar® è preparato a partire dalle cellule del paziente stesso e non presenta rischio di rigetto, quindi non è necessario agire sul sistema immunitario del paziente prima del trapianto.
 Lembo di epitelio corneale coltivato in vitro (Holoclar®)
Lembo di epitelio corneale coltivato in vitro (Holoclar®)
Holoclar® è preparato partendo da un piccolo campione di cellule, ottenute attraverso il prelievo di una biopsia di 1-2 mm2 di limbus (la zona della cornea dove sono contenute le staminali corneali) non danneggiato da uno degli occhi. Le cellule estratte dalla biopsia vengono seminate su un substrato di fibrina umana modificata e coltivate in laboratorio per produrre un tessuto epiteliale da trapiantare nell’occhio danneggiato del paziente e le cellule staminali contenute nel tessuto consentono la rigenerazione permanente della cornea grazie alla quale è possibile arrivare al pieno recupero della capacità visiva. Holoclar® è preparato a partire dalle cellule del paziente stesso e non presenta rischio di rigetto, quindi non è necessario agire sul sistema immunitario del paziente prima del trapianto.
Holoclar® è il primo prodotto farmaceutico a base di cellule staminali registrato in Europa (Febbraio 2015). Questo successo, tutto italiano, si deve al prezioso connubio tra le capacità scientifiche di ricercatori di fama mondiale, come Graziella Pellegrini e Michele De Luca dell’Università degli Studi di Modena e Reggio Emilia e le capacità industriali e la vocazione all’innovazione di Chiesi Farmaceutici attraverso lo spin-off Holostem Terapie Avanzate.
Holoclar® può essere utilizzato nei casi di deficit di cellule staminali limbari da moderato a severo causato da ustioni oculari che possono colpire uno o entrambi gli occhi e creare danni superficiali o profondi. Holoclar® può essere applicato a beneficio di questi pazienti a patto che l’ustione abbia lasciato almeno qualche mm di limbus integro in uno degli occhi.
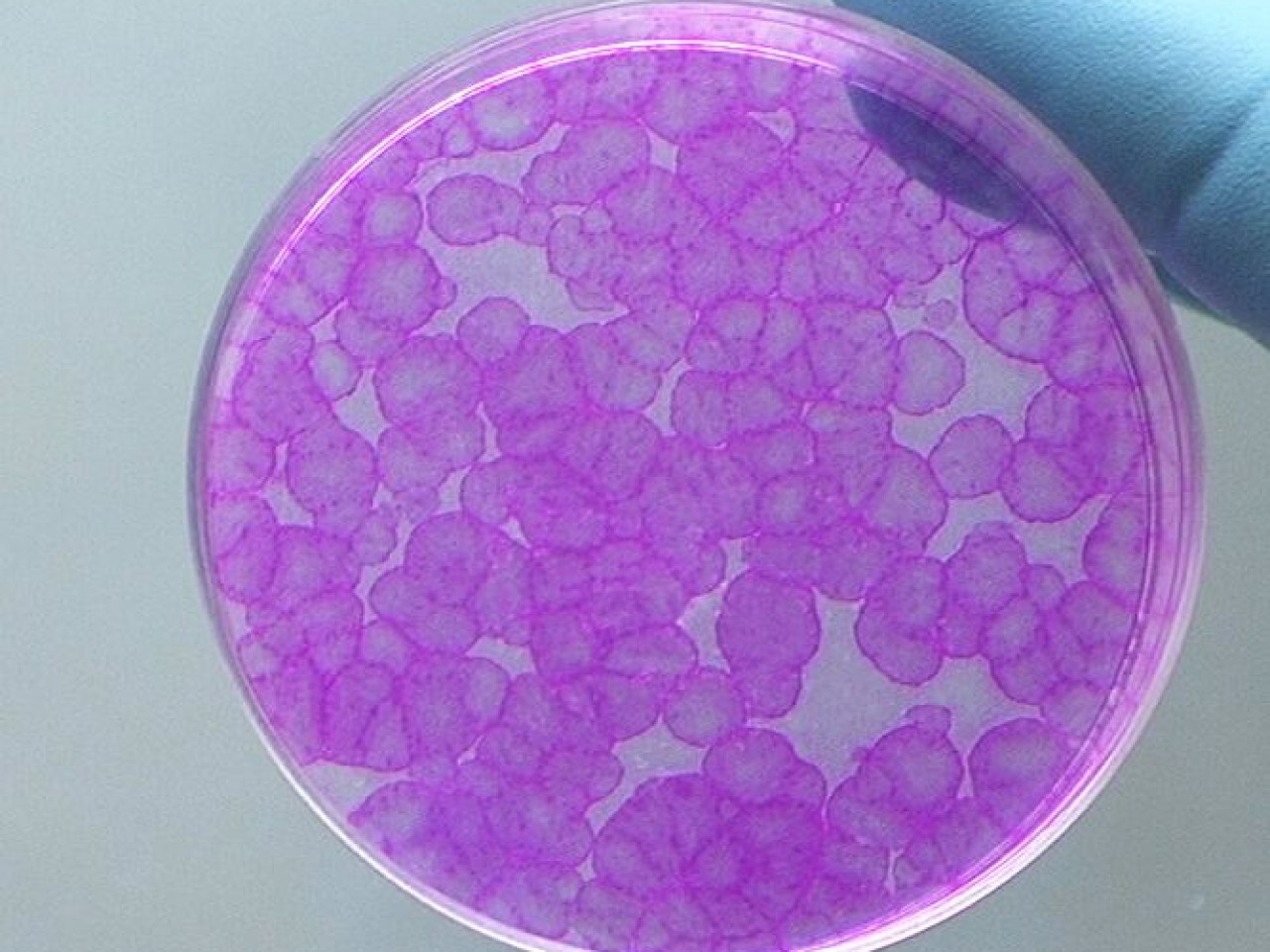 Colonie di cellule epiteliali ottenute da una cellula staminale
Colonie di cellule epiteliali ottenute da una cellula staminale
Applicazione clinica in oftalmologia
Prima di procedere all’intervento, le condizioni dell’occhio devono essere ricondotte alla normalità: spesso le ustioni non riguardano solo la cornea, ma l’occhio nella sua interezza. Se la lesione è profonda e coinvolge anche la parte sottostante l'epitelio corneale, l’innesto di Holoclar® è fondamentale per poter procedere, mediamente dopo un anno, al trapianto tradizionale di cornea. Se il limbus è completamente compromesso, infatti, il trapianto di cornea è destinato all'insuccesso perché il tessuto corneale che si impianta non viene ricoperto dall’epitelio corneale, come normalmente accadrebbe, ma dalle cellule della congiuntiva, che rendono opaca la cornea. Il trattamento è stato applicato per la prima volta sugli esseri umani in via sperimentale negli anni novanta (LANCET 1997, N Engl J Med 2010) ed è stato riconosciuto come farmaco orfano nel 2008. A febbraio del 2015, il prodotto ha ricevuto l’autorizzazione condizionata all’immissione in commercio dalla Comunità europea. Ad oggi, sono stati trattati alcune centinaia di pazienti, ottenendo un successo totale in più del 70% di casi e un successo parziale in circa il 15% dei casi.
Holostem Terapie Avanzate s.r.l. (manufacturer) Chiesi Farmaceutici S.r.l. (titolare dell'autorizzazione all'immissione in commercio)
De Luca M. and Pellegrini G., In vitro reconstituted sheets of human corneal epithelium and method of producing the same, EP Patent 1451302, May 28, 2008 De Luca M. and Pellegrini G., Reconstructed laminae of human epithelium corneae and method of producing the same, US Patent 6,610,538, Aug. 26, 2003
 Un corridoio dell'area GMP
Un corridoio dell'area GMP

