Polveri inalatorie contenenti un anestetico locale in combinazione con un polimero biocompatibile idrofilo in grado di indurre una soppressione prolungata della tosse.
Queste polveri sono composte di microparticelle in grado di depositarsi nella parte superiore del tratto respiratorio dove lo stimolo tussivo è generato ed in grado di modulare il rilascio del farmaco anestetico locale.
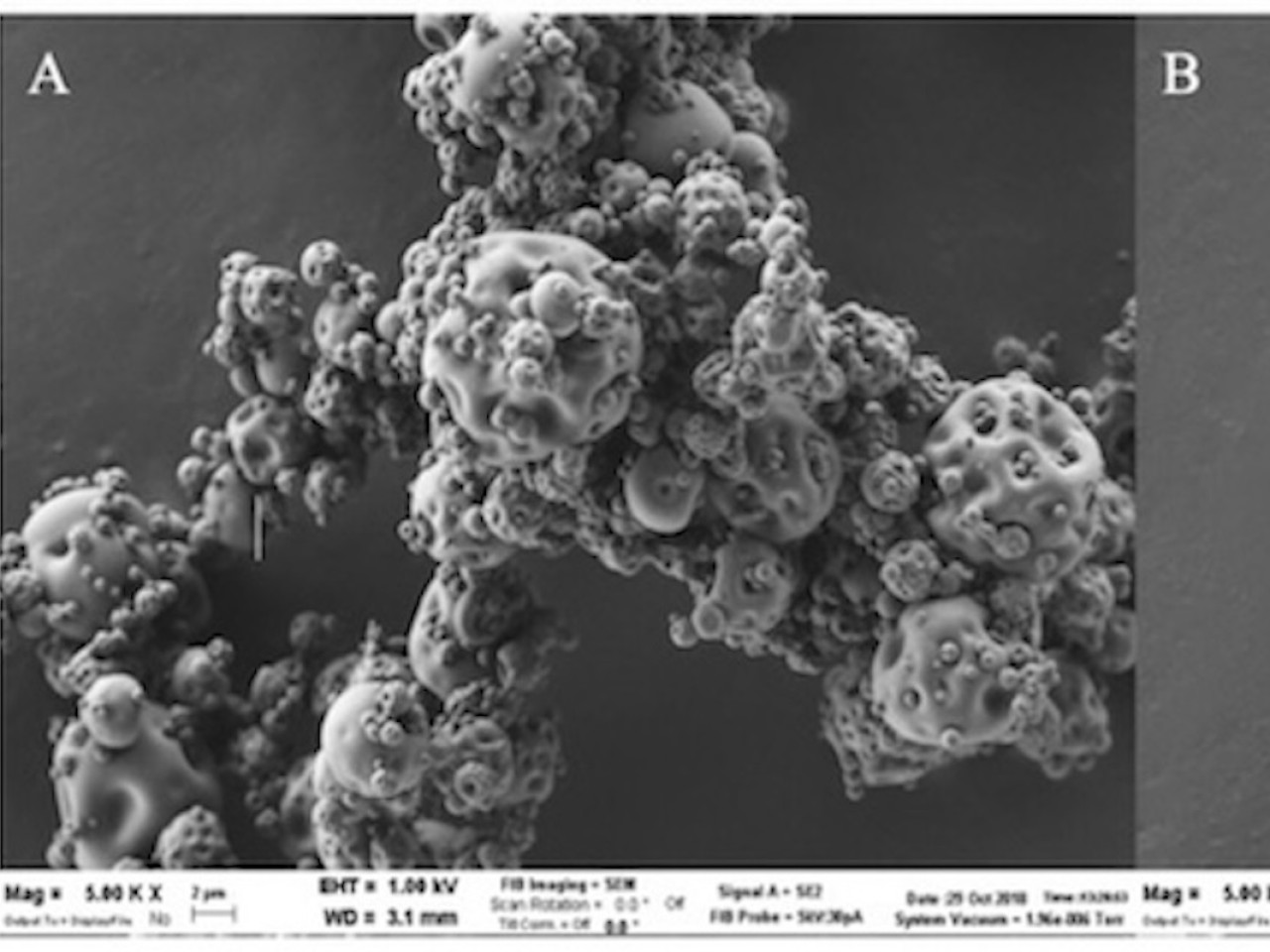 Immagine al microscopio a scansione di particelle della polvere di anestetico locale ottenute per spray drying
Immagine al microscopio a scansione di particelle della polvere di anestetico locale ottenute per spray drying
La tosse è un disturbo respiratorio molto comune. La tosse cronica (> 8 settimane) può essere estremamente dannosa per la vita del paziente e clinicamente difficile da trattare. Una percentuale di pazienti con tosse cronica presenta una tosse persistente chiamata tosse cronica idiopatica, che rimane inspiegabile, e si verifica quando i recettori della tosse sono eccessivamente sensibili agli stimoli prodotti da irritanti non specifici. Gli anestetici locali (LANE) possono agire come farmaci antitosse localmente riducendo l'eccitabilità dei i nervi responsabili del riflesso della tosse. L'uso off label dei LANE nella tosse cronica è stato recentemente oggetto di uno studio clinico retrospettivo che ha evidenziato promettenti risultati quando lidocaina era somministrata ad adulti con nebulizzatori.
Lo scopo di questa ricerca è stato quello di progettare e produrre una polvere per inalazione, a base di lidocaina, per il trattamento della tosse cronica. La lidocaina è stata essiccata con metodo spray drying in associazione all’acido ialuronico (HA) per ottenere polveri inalabili. Le polveri ottenute composte da HA a basso peso molecolare con un contenuto di lidocaina inferiore al 20% hanno offerto un profilo di dissoluzione adeguato e una maggiore stabilità fisica. L'uso di un polimero come l'HA ha portato a un intrappolamento ottimale del farmaco consentendo la produzione di particelle amorfe e di modulare il rilascio del farmaco.
L'attuale trattamento della tosse cronica prevede l'uso di neuromodulatori ad azione centrale per via orale, come amitriptilina, gabapentin, pregabalin e tramadolo. Ad oggi, nessun prodotto per inalazione a base di anestetici locali è autorizzato per questa indicazione. La polvere per inalazione sviluppata in questa ricerca contiene lidocaina e acido ialuronico ed è composta da particelle in un intervallo dimensionale (6-12 μm) adatto alla deposizione nella parte superiore delle vie aeree dove sono localizzati i recettori della tosse. Lo specifico contenuto in acido ialuronico nella formulazione permette di ottenere microparticelle amorfe, bioadesive e in grado di rilasciare in maniera controllata la lidocaina e, di conseguenza, capaci di determinare un'efficiente soppressione della tosse.
La presente invenzione riguarda una combinazione di un farmaco anestetico locale (LANE) con un polimero biocompatibile idrofilo da somministrare come formulazione di polvere secca per inalazione attraverso un inalatore di polvere secca (DPI) per il trattamento della tosse cronica e la prevenzione della tosse indotta da trattamenti farmacologici, nonché per il trattamento della tosse acuta, ad es. in corso di infezioni virali delle vie aeree o nella tosse post-infettiva.
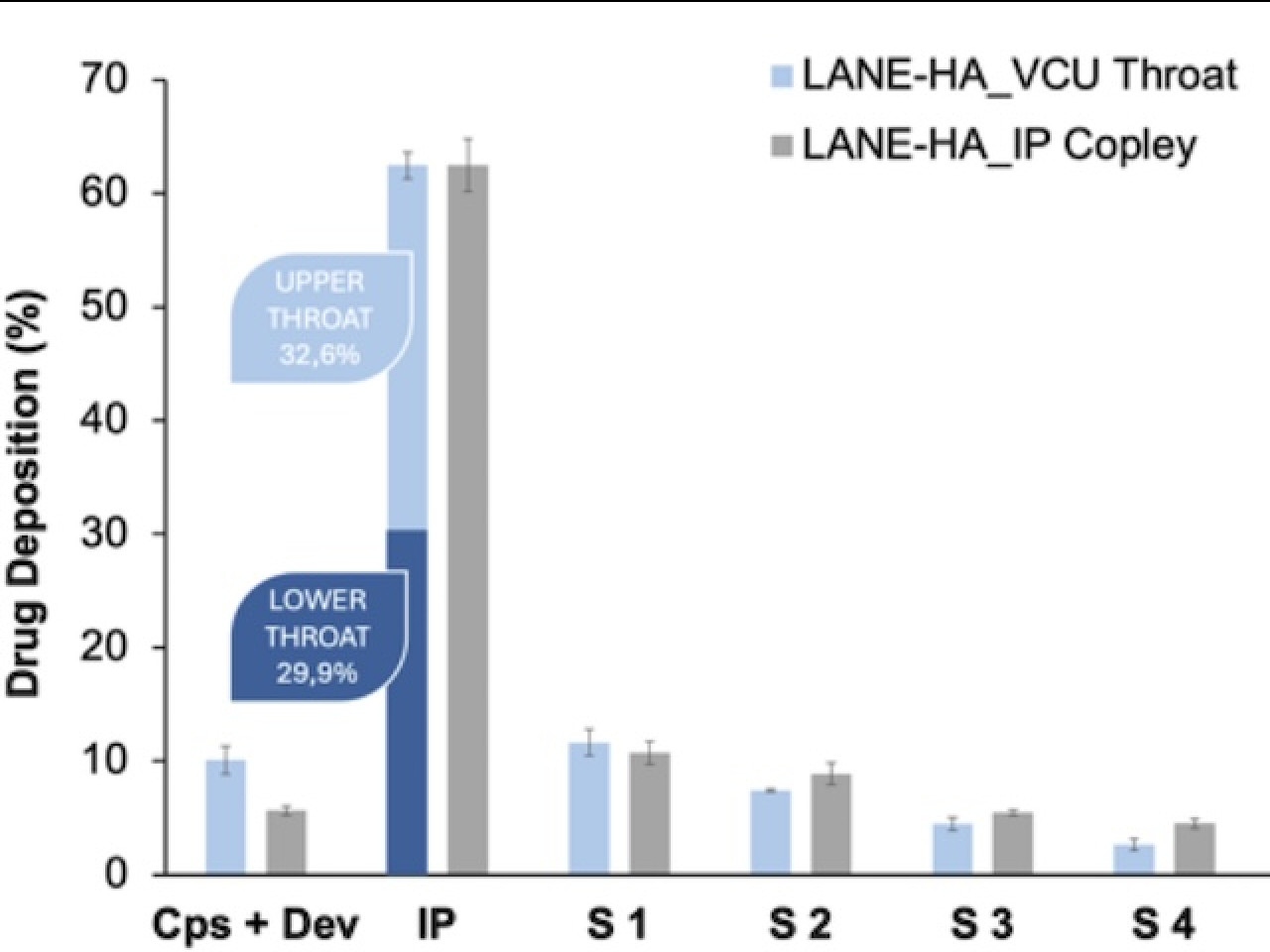 Deposizione della polvere di anestetico locale ottenute per spray drying in esperimenti con Next Generation Impactor montato con Standard Induction Port (grigio) o modello realistico di gola (blu).
Deposizione della polvere di anestetico locale ottenute per spray drying in esperimenti con Next Generation Impactor montato con Standard Induction Port (grigio) o modello realistico di gola (blu).
Produzione di polveri inalabili per spray dyring contenenti un anestetico locale in combinazione con un polimero biocompatibile idrofilo e studio della loro efficacia nell'indurre una soppressione della tosse in volontari sani
Le polveri spray dried composte da acido ialuronico a basso peso molecolare con un contenuto di lidocaina inferiore al 20% hanno fornito il profilo di dissoluzione e la stabilità fisica desiderati. Le prestazioni aerodinamiche delle polveri prodotte sono state testate utilizzando un Next Generation Impactor dotato di una standard USP Induction Port o un modello realistico del tratto bocca-gola. Risultati di deposizione simili sono stati ottenuti con entrambe le geometrie, con un'elevata deposizione a livello della gola (circa il 60%) e una deposizione minima negli stadi più profondi, indicando un potenziale targeting delle vie aeree superiori dove sono localizzati i recettori della tosse e un basso assorbimento sistemico responsabile degli effetti collaterali. Il profilo di rilascio della materia prima lidocaina e della lidocaina dalla formulazione è stato condotto utilizzando RespiCell,™ un apparato progettato dall'Università di Parma per test di dissoluzione in vitro di prodotti inalatori. La dissoluzione della polvere essiccata a spruzzo è stata significativamente più lenta (120 minuti contro 15) rispetto alla materia prima e lidocaina.
Infine, è stato condotto uno studio su volontari sani ai quali la tosse è stata indotta tramite inalazione di acqua distillata (Ospedale Careggi, Firenze, Italia). L’intensità dello stimolo tussivo (UTC) è stata valutata per mezzo di una scala analogica visiva. Lo studio ha dimostrato che l'inalazione della polvere ha aumentato significativamente la soglia della tosse e l'UTC nei soggetti testati con un aumento mediano di 2,13 volte e una durata media dell'effetto di 50 ± 8 minuti.
Università di Firenze, Azienda Ospedaliero Universitaria Careggi
La polvere inalatoria contenente anestetici locali è protetta da brevetto italiano (n°IT202100031637A1) registrato nel mese di giugno 2023 ed esteso come domanda internazionale nel giugno 2024.
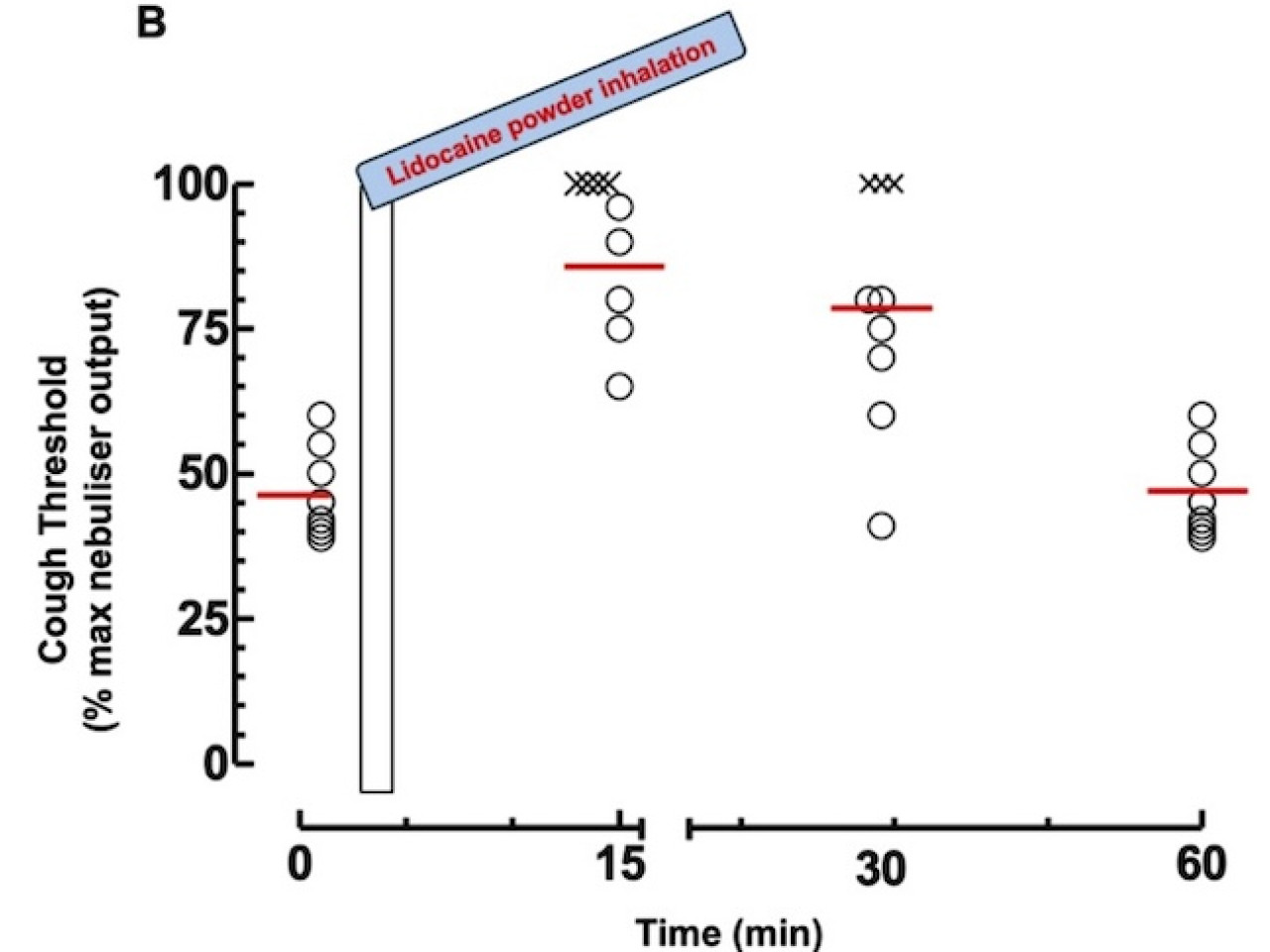 Livello di stimolo del riflesso tussivo a differenti tempi dopo inalazione da parte di volontari sani delle polveri di lidocaina ottenute per spray drying
Livello di stimolo del riflesso tussivo a differenti tempi dopo inalazione da parte di volontari sani delle polveri di lidocaina ottenute per spray drying

