Il servizio comprende studi di efficacia e studi di sicurezza certificati in accordo con le Good Laboratory Practice (GLP). E’ ottimizzato per la validazione dei risultati in ambito internazionale, e per il loro impiego ai fini della domanda IND (Investigational New Drug). Comprende quindi un disegno dello studio basato su end-point primario ed esploratori, calcolo di potenza per la determinazione del campione, read-out allineati ai rispettivi gold standard. Il servizio è applicato allo sviluppo di farmaci anti-Alzheimer, neuroprotettori, agenti rimielinizzanti; allo sviluppo di terapie enzimatiche e geniche per malattie rare; per farmaci e biomateriali a uso topico per la riparazione di ferite di difficile guarigione, compreso il piede diabetico. Viene inoltre applicato a studi di efficacia e sicurezza di dispositivi elettromedicali (campi elettromagnetici, laser, radiofrequenze) per applicazioni sistemiche e loco-regionali.
 Fondazione IRET – soggetto gestore del Tecnopolo di Bologna sede di Ozzano dell’Emilia “Rita Levi Montalcini”
Fondazione IRET – soggetto gestore del Tecnopolo di Bologna sede di Ozzano dell’Emilia “Rita Levi Montalcini”
Il servizio comprende test di efficacia preclinica su modelli animali di malattia (animale da laboratorio), e studi di tossicità in vivo certificati GLP. Prevede analisi di endopoints comportamentali (videotracking e analisi computerizzata), morfologici (istologia e immunoistochimica con microscopia convenzionale, a fluorescenza, confocale a scansione laser e analisi computerizzata dell’immagine), molecolare (trascrittomica) e biomarkers (proteomica). Ha i suoi punti di forza nelle elevate competenze del personale, l’automatizzazione delle tecnologie high- throughput, nella rapidità di progettazione ed esecuzione degli studi. Ha inoltre un servizio veterinario interno, che gestisce in proprio la procedura autorizzativa delle sperimentazioni. Comprende attività di biomarker discovery su diverse matrici e relativa validazione basata su tecnologie analitiche mutiparametriche, i cui protocolli sono stati validati per studi clinici controllati EMA e FDA. Presso IRET è quindi possibile sviluppare il prodotto dalla preclinica alla fase clinica, in una filiera che include la validazione internazionale dei diversi segmenti di attività. IRET ha inoltre sviluppato una particolare competenza nella customizzazione dei modelli, in relazione alle specifiche esigenze.
Il servizio è ottimizzato per fornire alle aziende farmaceutiche e biomedicali risultati derivati da un solido disegno statistico dello studio basato sull’analisi di potenza, realizzato nei tempi minimo previsti dalla sperimentazione, i cui risultati vengono presentati come “rapporti di prova” includendo il data-base dei dati originali, oltre che le analisi statistiche. In questo modo il rapporto di prova può entrare a far parte della domanda IND.
Il servizio è correntemente applicato per malattie e lesioni di ambito neurologico (malattie neurodegenerative, lesioni traumatiche e vascolari del sistema nervoso, dolore infiammatorio e neuropatico), reumatologico (artriti), endocrino-metabolico, lesioni di epiteli (ulcere da pressione, piede diabetico, lesioni corneali), malattie rare.
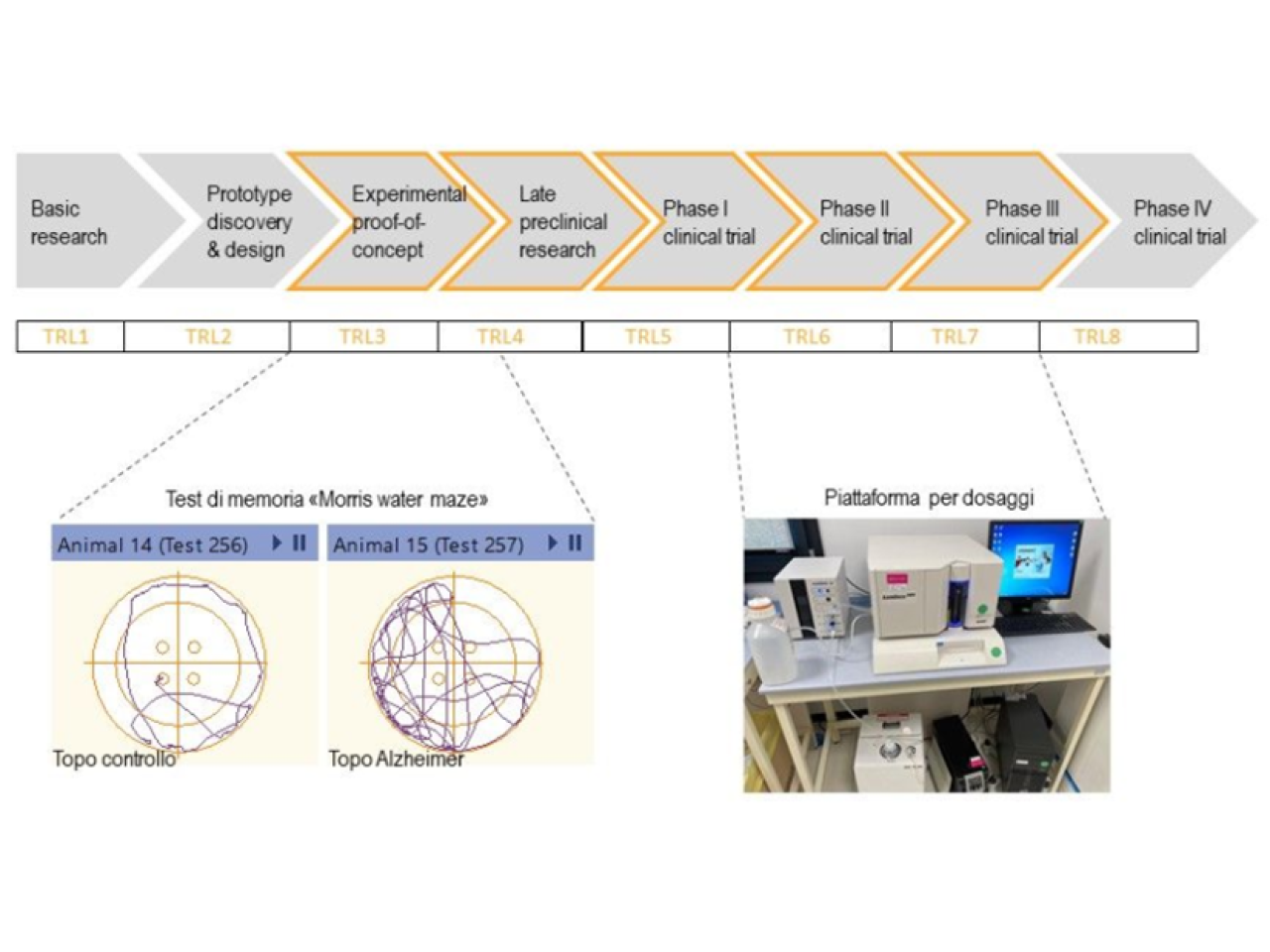 Fondazione IRET offre il servizio sviluppo prodotti dal preclinico (TRL3) alla sperimentazione clinica (TRL7), con procedure validate in accordo con le linee guida delle agenzie regolatorie competenti
Fondazione IRET offre il servizio sviluppo prodotti dal preclinico (TRL3) alla sperimentazione clinica (TRL7), con procedure validate in accordo con le linee guida delle agenzie regolatorie competenti
Sviluppo di una molecola anti-Alzheimer.
Nel 2006, Chiesi Farmaceutici contatta Fondazione IRET per uno studio preclinico relativo ad un nuovo modulatore della gamma-secretasi (CHF7054) per la demenza di Alzheimer. Viene richiesto di produrre prove di efficacia nel modello preclinico della malattia (topo transgenico), su memoria e biomarkers di malattia (concentrazione di AB40/AB42, Tau/Ptau in sangue e liquidi cerebrospinale, deposito di placche amiloidi nel tessuto cerebrale, neuroinfiammazione) da utilizzare nella IND (Investigational New Drug). Fra il 2010 e il 2014 i risultati sono stati validati attraverso la pubblicazione sulle migliori riviste internazionali di settore, consentendo l’avvio di studi clinici di Fase I e II (ClinicalTrials.gov Identifier: NCT01303744, NCT01203384, NCT01258452, NCT01602393), ai quali IRET ha partecipato dosando biomarkers con protocolli validati (EMA e FDA). Nel 2010 Chiesi ha ottenuto l’approvazione dalla Regione Emilia-Romagna (Bando “Dai distretti produttivi ai distretti tecnologici”) per il progetto “Tecnologie innovative per la terapia causale delle malattie neurodegenerative” per lo sviluppo di CHF5074, al quale hanno collaborato 3 laboratori della rete (CIRI-SDV Università di Bologna; LTTA, Università di Ferrara; Fond. IRET, Ozzano Emilia) Nel 2014 Chiesi cede la molecola ad una start-up americana (transfer of license), nata per lo sviluppo di fase III della molecola.
Chiesi Farmaceutici; CIRI-SDV Università di Bologna; LTTA, Università di Ferrara
Dall’esperienza maturata nello sviluppo di questo prodotto, sono derivate, negli ultimi 5 anni, servizi ad altre aziende farmaceutiche (N=3), biomedicali e elettromedicali (N=3). E’ stato inoltre creato lo spinn-off TransMed Research per gestire le attività certificate GLP, in accordo ai disciplinari AIFA, EMA e FDA
 Sviluppo, validazione e valorizzazione del prodotto CHF5074, da TRL 3 a TRL 7.
Sviluppo, validazione e valorizzazione del prodotto CHF5074, da TRL 3 a TRL 7.

